学院概况
About-
-
新闻公告
News -
师资队伍
Faculty -
科学研究
Research -
教学工作
Teaching -
学生事务
Student -
学院招生
Admission -
招聘信息
Careers
学院概况
About新闻公告
News师资队伍
Faculty科学研究
Research教学工作
Teaching学生事务
Student学院招生
Admission招聘信息
CareersResearch
近日,深圳大学医学部生物医学工程学院黄鹏特聘教授团队张一帆助理教授在Science合作期刊Research(影响因子11.0,中科院一区,TOP期刊)上发表了题为“Traceable Lactate-Fueled Self-Acting Photodynamic Therapy Against Triple-Negative Breast Cancer”的研究论文。

三阴性乳腺癌(TNBC)是乳腺癌中预后最差的一种亚型,主要原因是除全身化疗外缺乏其他有效的治疗方法,而且具有侵袭性。光动力疗法(PDT)通过时空控制的光照实现癌症靶向治疗,产生足够的单线态氧消灭肿瘤细胞。然而,TNBC肿瘤的缺氧状态严重阻碍了PDT的氧气供应。此外,光在TNBC肿瘤中的穿透深度有限,为避免组织穿透过程,使用共载能量源直接激活光敏剂是对包括TNBC在内的深部实体瘤进行有效PDT治疗的一种新型途径,但这种疗法仍受到肿瘤乏氧的限制。目前,对自发光PDT供氧的研究仍处于起步阶段。TNBC肿瘤中乳酸(LA)的过度产生与肿瘤的快速进展、侵袭性以及对传统疗法的耐受有关。LA氧化酶(LOx)可催化瘤内LA氧化并产生双氧水,通过连锁反应开启后续的协同治疗,如化疗和化学动力疗法。然而,目前还缺乏监测体内连锁反应的可行方法。
为了解决上述问题,该团队通过在中空二氧化锰纳米粒子中共同负载光克洛(HPPH或Photochlor®)、发光酚和LOx,制备了一种可追踪的以LA为燃料的自运行PDT纳米体系。为了增强肿瘤靶向能力并保护LOx不被水解,制备的纳米粒子用透明质酸(HA)装饰(HLMLH)。刚开始,LOx消耗瘤内LA并产生双氧水。随后,生成的双氧水氧化发光酚产生氨酞酸根离子,并发出蓝色荧光,在约440 nm处达到峰值。然后,化学发光通过发光酚和HPPH之间的化学能量共振转移(CRET)激活HPPH,从而实现荧光成像引导的PDT。同时,中空二氧化锰载体在酸性肿瘤微环境中被双氧水降解并产生氧气,从而改善TNBC肿瘤的缺氧状况,成为PDT的来源。这一过程伴随着锰离子的生成,锰离子不仅可作为活化MRI的T1造影剂,还能催化双氧水分解产生羟基自由基并增强化学发光。因此,HLMLH纳米系统有望对TNBC进行可追踪的自发光/自供氧PDT。
该团队张一帆助理教授和冯光乐硕士生为论文共同第一作者,黄鹏教授为通讯作者,深圳大学为唯一完成单位,该团队所在的生物医学工程学科属于广东省优势重点学科。本研究工作得到了国家重点研发计划、国家自然科学基金、广东省基础研究计划、深圳市科技计划等项目的支持。
论文链接:https://spj.science.org/doi/abs/10.34133/research.0277
Nano Today
近日,深圳大学医学部生物医学工程学院黄鹏特聘教授团队张一帆助理教授在国际顶级学术期刊Nano Today(影响因子18.962,中科院一区,TOP期刊)上发表了题为“Genetically engineered eukaryocyte-bacteria hybrid membrane-camouflaged nanoemulsion for three-pronged synergistic cancer therapy”的研究论文。

尽管免疫检查点阻断疗法(ICB)具有巨大的临床优势,但它仍然存在一些缺点,如反应率低、脱靶毒性和成本高昂。光热治疗(PTT)可引起肿瘤免疫原性细胞死亡,改善免疫抑制肿瘤微环境,提高ICB的响应率。然而,传统的PTT过程由于光热转换剂的分布不可避免地会对非癌区域造成损伤,这严重限制了其广泛的临床应用。细胞膜修饰赋予了纳米药物更多的膜本身的生物功能。细菌外膜囊泡(OMVs)可作为细菌免疫佐剂,激活先天免疫系统,还可提高干扰素-γ的表达。而PD-L1的表达可由多种细胞因子诱导或维持,其中以IFN-γ的作用最强。
因此,OMVs有可能直接上调PD-L1的表达,从而加强ICB的疗效。为了提高ICB的治疗效果,并降低其治疗成本,基于上述研究发现,该团队设计并制备了一种由真核生物基因工程改造细胞膜与原核生物外膜囊泡组成的融合膜PSHM,其中真核生物膜来自于高表达PD-1蛋白的人肾上皮HEK293T细胞(PM),原核生物膜来自减毒的厌氧菌沙门氏菌OMVs(SM)。然后通过共挤出的方法包覆于乳酸氧化酶-全氟三丁胺纳米乳液的外层(PHL@PSHM),从而实现了三管齐下的协光热-免疫协同疗法,显著提高了PD-L1抑制的免疫治疗效果(如下图)。
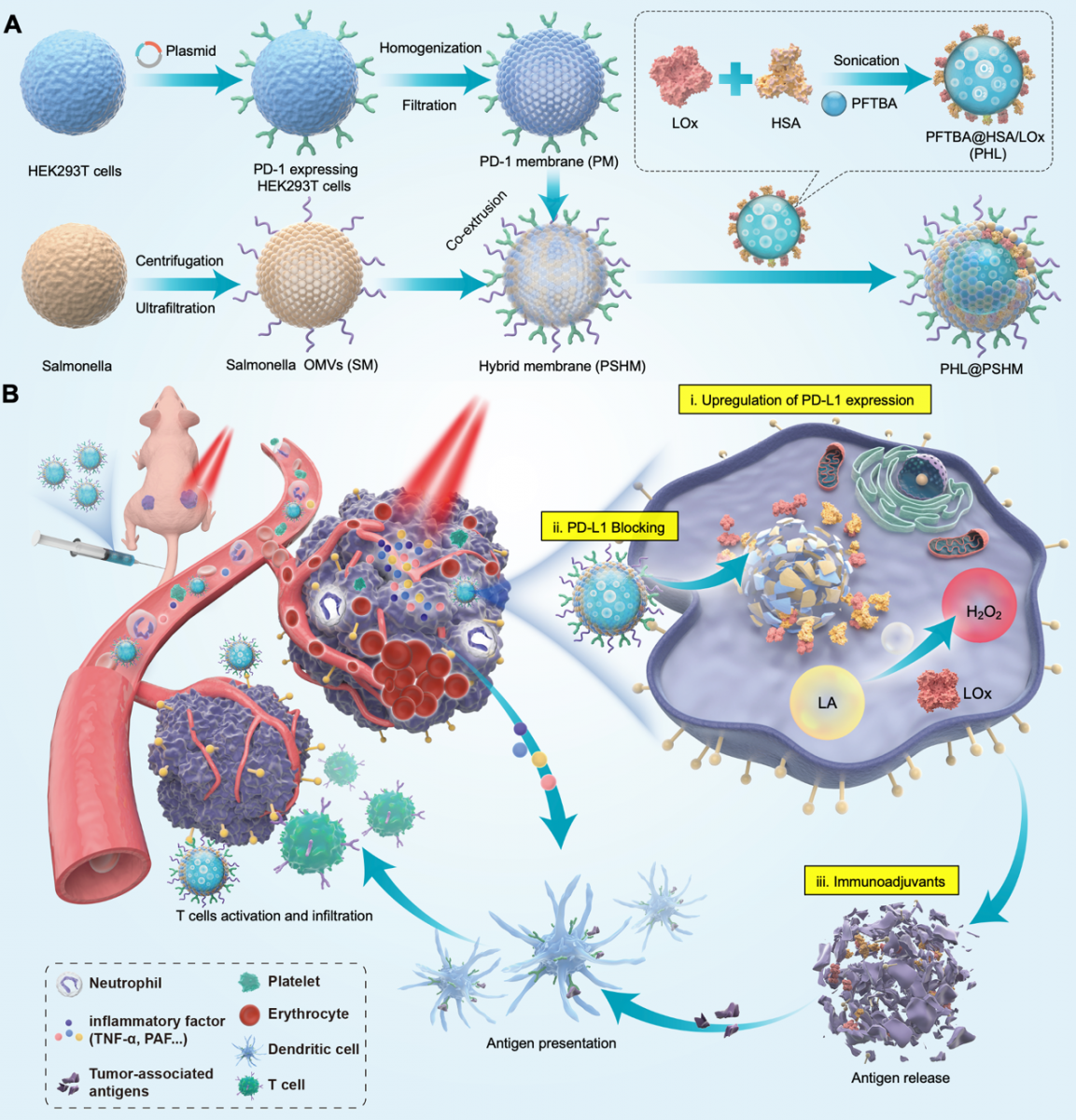
首先,沙门氏菌外膜囊泡(SM)能上调肿瘤细胞的PD-L1表达,提高PD-L1阻断治疗的反应率。其次,融合膜将纳米乳液靶向于缺氧的肿瘤,实现由PD-1蛋白介导的靶向肿瘤细胞表面PD-L1的阻断。再者,SM可诱导红细胞外渗到肿瘤中,在不损伤周围组织的情况下对肿瘤进行光热消融,从而引起免疫原性细胞死亡,改善免疫抑制性的肿瘤微环境,提高ICB治疗效果。这种光热治疗是基于肿瘤组织自身浸润的血红蛋白等吸光物质,具有极高的组织特异性。PHL@PSHM在三阴性乳腺癌和结肠癌皮下移植瘤模型中均实现了对原位皮下瘤和远端转移瘤的高效抑制,显著延长了小鼠的存活期。
该团队张一帆助理教授和廖云燕硕士生、白放硕士生为论文共同第一作者,黄鹏教授为通讯作者,深圳大学为唯一完成单位,该团队所在的生物医学工程学科属于广东省优势重点学科。本研究工作得到了国家重点研发计划、国家自然科学基金、广东省基础研究计划、深圳市科技计划等项目的支持。
论文链接:https://www.sciencedirect.com/science/article/pii/S1748013223003250