2025年6月27日上午10:00,深医讲坛第一百三十八讲在深圳大学丽湖校区沙河苑顺利举办。此次讲坛由深圳大学医学部生物医学工程学院余夏夏老师主持,美国宾夕法尼亚大学佩雷尔曼医学院生物统计学、流行病学与信息学系黄静副教授担任主讲嘉宾,带来题为“面向未来的流行病模型构建与准备”的精彩学术分享。
在讲座中,黄教授以时间脉络为轴,深入梳理了流行病研究的历史演进轨迹,并对流行病学中疫情预测模型的构建体系进行了系统性阐释。
她从经典的 Susceptible-Infectious-Recovered(SIR)模型切入,逐步解析该模型如何通过理论迭代与技术创新,最终实现从学术构想向具备实践指导价值成果的蜕变,围绕数据分析的关键要点、模型构建的核心逻辑以及成果落地的应用路径三个维度,展开了全面且深入的探讨。
流行病建模“前世今生”
流行病学(Epidemiology)是研究疾病在人群中分布及其影响因素的科学,其核心在于通过数学模型为公共卫生决策提供依据。
早在十八世纪,数学家丹尼尔·伯努利 (1766)就开创性地将微积分应用于天花疫苗效果评估,通过建立数学模型证实了人痘接种能显著延长人群寿命,这一探索为流行病数学建模奠定了基础。
经典房室模型的演进
1.SIR 模型的基础框架
作为最经典的流行病模型,房室模型(Compartmental Model)通过将人群分为易感、感染和康复三个状态(易感人群(S)、感染人群(I)、康复人群(R)),作为现代流行病学预测和公共卫生规划的基本框架,通过一组微分方程描述疾病传播过程。
Susceptible-Infectious-Recovered (SIR,易感、感染、康复)模型是最基本、最简单的房室模型之一,易感人群感染速率与易感者和感染者的接触频率相关,而感染人群康复速率则由疾病自然病程决定。其核心公式可简化为:

其中,S(t)、I(t)和R(t)分别为t时刻易感人群、感染人群和康复人群的数量,β表示导致新增感染的有效接触率,γ表示康复率,N为总人口模型,假定为常数,即N = S(t)+I(t)+R(t)。
2.模型的动态进化
近几十年来,随着对疾病传播规律的深入认识,传统的房室模型不断发展,能够更好地捕捉疾病传播的复杂性。空间房室模型将地理位置纳入疾病传播动态,扩展了传统的房室方法。这使得研究者可以将传播异质性纳入模型并模拟不同区域的疾病传播。
传统房室模型的一个局限性在于,它们假设疫情期间传播率恒定不变。然而,现实世界的疫情爆发受动态因素的影响,这些因素会随时间显著改变疾病的传播率。而时变 SIR 模型考虑到现实中传播率会随时间变化(如季节因素、防控措施实施),通过引入随时间变化的参数,使模型更贴合实际疫情发展。其微分方程如下:

其中,β(t)和γ(t)分别代表随时间变化的传播率和治愈率。
3.感染时间模型的创新
传统房室模型的一个基本假设是同质性,这一假设往往无法反映不同人群的现实情况。不同于传统模型关注群体状态转移,感染时间 (Time-Since-Infection,TSI) 模型聚焦个体感染的时间线,通过分析“新感染个体何时被现有感染者传染”的时间分布,揭示疾病传播的时间规律。
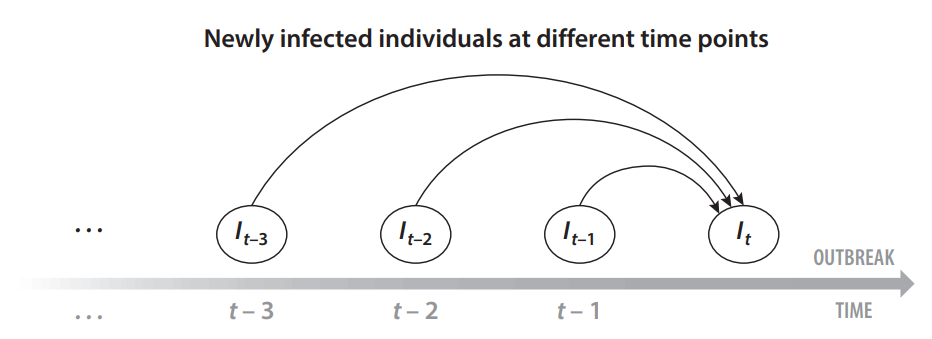
该模型假设在时间t新感染的所有个体都是被现有的感染个体感染的,而这些感染个体可能在t之前的任何时间被感染,如下图,I_t表示时间 t时新感染个体的数量。研究发现多数传染病存在“传染性高峰期”,这为确定隔离周期提供了科学依据。
区域性建模“疫情水晶球”
在流行病预测中,全局模型常面临“无法指导本地决策”的挑战。黄教授团队以美国疫情为例,在三月份数据有限的情况下,研究团队利用全美温度跨度大的特点进行回归分析。利用不同地区气候差异显著的特点,通过回归分析构建区域性模型。
通过区域性模型对美国费城的疫情感染人群进行了预测,大部分预测结果与实际感染人数接近,尽管在某些高点预测存在偏差,整体预测准确性较高。该模型的关键创新在于引入 “地区特异性参数”,包括:
- 人口特征:年龄结构、人口密度
- 医疗资源:医院床位容量
- 政策因素:防控措施严格程度
通过整合这些参数,模型对当地感染人数的预测准确率较高,能够为区域防控提供有效参考。
时间感染模型“隔离策略支持”
鉴于建模时应实时关注疾病的传播和实时再生因素,研究团队进一步提出基于感染时间的Time-Since-Infection(TSI) 模型,关注感染人群在不同时间段的感染变化,可以预测特定时间点的新增感染人数,进而解释了感染率随时间变化及康复过程。基于感染时间模型的深入分析,研究团队发现了疾病传播的重要规律:多数传染病在感染初期传染性最强,而随着时间推移传染性会显著下降。这一发现直接为隔离政策优化提供了依据:例如“感染后前 3 天需严格隔离”的策略建议。
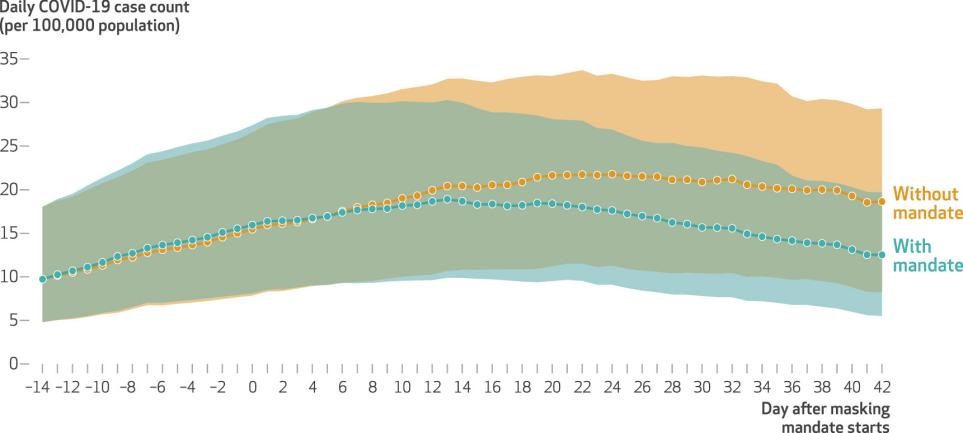
同时,通过对比不同防控措施的实施效果,模型证实了非药物干预手段的有效性。以 “口罩令” 为例,数据显示实施该政策的地区每日新增病例数显著低于未实施地区,这为公共卫生政策的制定提供了量化支撑。
早期预警新武器“疫情预言家”
TSI 模型主要依赖单一的发病数据,这种对发病率数据的依赖可能会因漏报或报告延迟而引入偏差。但实际疫情中,住院数据、医疗资源使用情况等都是重要的参考指标。当其他关键数据(例如住院人数)可用时,传统的TSI模型无法整合这些信息。
这是因为它们假设每例新感染都与先前病例相关,而住院数据并不遵循这种模式。这一局限性限制了TSI模型有效地模拟疾病相关的住院情况,而住院情况是评估疫情轨迹和规划医疗资源的重要指标。
为解决这一问题,研究团队提出了整合多源数据的复合模型,通过使用复合似然函数处理发病率与住院数据的复杂依赖关系,解决了统计难点,整合了新增感染人数和住院人数,构建了一个新模型,该模型进一步应用到美国四大城市的实时数据,成功实现了对每日新增感染和住院人数的同步预测,为医疗资源调配提供了更精准的依据。
未来已来“AI+公共卫生”
最后,黄教授分享了在疫情期间进行流行病预测的惊心动魄和重要意义,强调了模型和数据在流行病预测中的相互作用。
在互动环节,师生们就如何在模型中考虑病原体变异、疫苗接种等因素,疫情预测中实际走向出现下降趋势的因素,经济因素对疫情政策调整的影响,如何优化数据模型,关键预测因素对疾病传播的影响等问题踊跃提问。
黄静教授结合自身科研经历与师生们进行了深入探讨,鼓励青年学者将人工智能运用到公共卫生领域,在增强民众信任、优化政策传达及高效处理数据等方面起到重要作用,提升公共卫生响应速度和效率。
嘉宾介绍

黄静,宾夕法尼亚大学佩雷尔曼医学院生物统计学、流行病学与信息学系副教授(终身教职),费城儿童医院PolicyLab观察性研究副主任、临床流行病与生物统计学中心高级学者。
长期致力于电子健康记录数据建模、传染病预测、个体化干预策略与多源数据整合等研究,推动统计方法在公共卫生与临床实践中的应用。作为“COVID-Lab”预测平台的牵头人之一,其模型成果被美国白宫、CDC及多州采纳,为疫情应对提供科学支撑。
近年主持多项NIH、CDC、PCORI资助项目,已在Nature Medicine、Biometrika、JAMA Network Open等国际期刊发表论文90余篇。研究成果在统计建模、健康信息学、儿科慢病与传染病领域具有重要影响。